- 8 сентября 2025
- 7 минут
- 4 388
Четвертичная структура белка: ее характеристика, особенности и функционирование, специфика олигомерных белков
Статью подготовили специалисты образовательного сервиса Zaochnik.
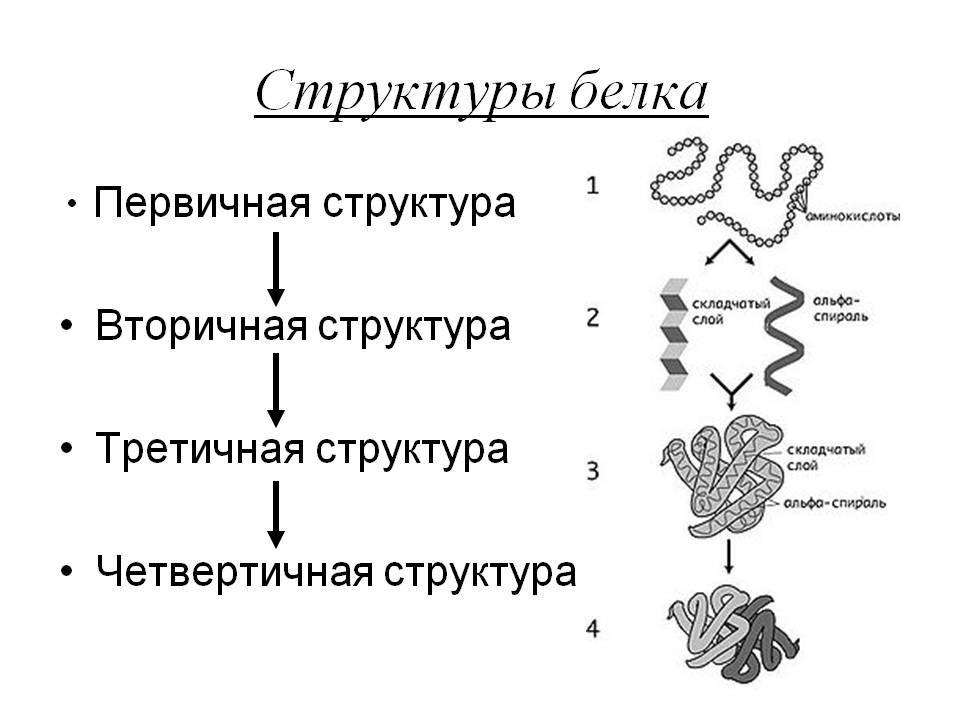
Четвертичная структура белка
Особенности четвертичной структуры
Четвертичная структура белка — это вариант того, как в пространстве укладываются отдельные полипептидные цепи, обладающие разной (может быть, одинаковой) первичной, вторичной и третичной структурой.
Вторичная структура белка представляет собой складчатый слой (альфа-спираль).
Почти все белковые молекулы могут сохранять свою биоактивность. Это значит, что они выполняют свойственные им функции исключительно в узком температурном диапазоне и в узком диапазоне кислотности среды.
В случаях, когда температура повышается или кислотность изменяется до экстремальных показателей, при добавлении гидрофобных агентов, к примеру, органических растворителей, увеличении концентрации солей, происходит изменения в структуре белков. Эти изменения становятся причиной денатурации — белок теряет свою естественную пространственную структуру.
При этом, разрушения первичной структуры белка не происходит.
Если исходить из структуры, то четвертичная структура белка — макромолекула. Множество функциональных белков состоит из полипептидных цепей, соединенных друг с другом несколькими главновалентными цепями. При этом ковалентные связи не наблюдаются.
Отдельную полипептидную цепь называют протомером, мономером или субъединицей, которая не отличается высокой функциональной активностью.
Эта способность появляется у белка при определенном варианте пространственного объединения мономеров. В результате возникает новое качество, не характерное для мономерного белка. Образующаяся в итоге молекула называется олигомером.
Специфика олигомерных белков
У олигомерных белков отмечаются следующие свойства:
- они состоят из четного числа протомеров. Обычно 2 или 4, но бывает и 6;
- у них одинаковые или разные молекулярные массы. При этом степень вариативности достаточно высокая.
К примеру, молекула гемоглобина включает две альфа- и две бета-полипептидные цепи. У этой молекулы форма тетрамера: это значит, что в ее состав входят 4 полипептидные цепи, регулярно взаимодействующие.
Каждая из этих цепей окружает специализированную группу гема-пигмента, которые отвечает за окрашивание крови в красный цвет. Молекула гемоглобина может подвергаться обратной диссоциации при определенных условиях. Формирование такого процесса происходит в результате влияния разрыва водородных связей. В случае, если мочевина и соли удаляются, исходная молекула гемоглобина подвергается автоматической ассоциации.
Стандартный пример олигомерной молекулы — вирус табачной мозаики, отличающийся гигантской молекулой. Длина этого вируса достигает 300 нм. Белковые частицы со спиралеобразной структурой (в ней содержится свыше 130 витков) нанизываются вокруг молекулы РНК.
У вируса есть невероятная способность: полная регенерация или восстановление четвертичной структуры. При этом наблюдается восстановление всех ее физических параметров и биологических функций.
Особенности функционирования четвертичной структуры
Внутри последовательности аминокислот есть информация, реализуемая на всех уровнях организации структуры молекулы белка.
У многих ферментов отмечается четвертичная структура. К примеру, фосфорилаза состоит из двух идентичных субъединиц, которые, в свою очередь, состоят из двух пептидных цепей. Из этого следует, что молекула — тетрамер. У отдельных субъединиц не наблюдается особенная каталитическая активность.
У любого регуляторного фермента — четвертичная структура и высокая скорость требуемых химических реакций в клетке.
Четвертичная структура белка довольно стабильна, хотя в отдельных случаях подвергается денатурации и последующему восстановлению (если выполняются некоторые условия вроде температуры, наличия катализаторов и др).
Характеристики четвертичной структуры белка
Для нескольких сотен белков четвертичная структура полностью расшифрована, хотя остается еще много белков с нерасшифрованной структурой. У этой структуры есть определенные характеристики:
- возможность стабилизации нековалентными связями четвертичной структуры белка;
- взаимодействие площадок протомеров на основе принципа комплементарности, то есть согласованности;
- сформированная в рибосоме структура белка может подвергаться модификации или посттрансляционному процессингу. Так происходит в случае превращения предшественников ряда ферментов или специализированных гормонов в вещества, отличающиеся более высоким порядком.
Все вышеописанное позволяет говорить о существовании четвертичной структуры белка низшего порядка. У каждого белка — собственная уникальная структура и специализированные функции. Если человек постигнет структуру всех белков, то это даст возможность понять, как функционируют живые организмы. В результате такого научного поиска:
- можно будет исследовать болезни человека, передающиеся по наследству;
- удастся выяснить структуры и системы биосинтеза белка.
Некоторые ученые считают, что существует пятый уровень организации структуры белка. Имеются в виду полифункциональные макромолекулярные комплексы.
Ассоциат представляет собой макромолекулярный белковый комплекс.
В этом случае ферменты — метаболоны и олигомеры. Они отвечают за катализацию всего пути превращений субстрата в синтетазы высших кислот, дыхательную цепь и пируватдегидрогеназный комплекс.
Говоря о структуре белка кратко, на основе описанного выше, можно утверждать, что взаимодействие между отдельными молекулами внутри четвертичной структуры белка открывает возможности для изменений ее пространственной структуры.
Конформация — расположение атомов и групп молекул органического вещества, которое обусловлено возможностями вращения этих молекул вокруг ковалентных связей.
Эти изменения — основа биологической активности белковых полимеров.




