- 24 июля 2025
- 6 минут
- 8 339
Кристаллические и аморфные тела
Статью подготовили специалисты образовательного сервиса Zaochnik.
В зависимости от физических свойств и молекулярной структуры выделяют два основных класса твердых тел – кристаллические и аморфные.
Аморфные тела обладают такой чертой, как изотропность. Это понятие означает, что они относительно независимы от оптических, механических и других физических свойств и направления, в котором на них воздействуют внешние силы.
Основная черта афморных тел – хаотичное расположение атомов и молекул, которые собираются лишь в небольшие локальные группы, не более чем по несколько частиц в каждой.
Это свойство сближает аморфные тела с жидкостями. К таким твердым телам относятся янтарь и другие твердые смолы, различные виды пластика и стекло. Под воздействием высоких температур аморфные тела размягчаются, однако для их перевода в жидкость необходимы сильные воздействия тепла.
Структура кристаллических тел
Все кристаллические тела имеют четкую внутреннюю структуру. Группы частиц в одном и том же порядке периодически повторяются во всем объеме такого тела. Чтобы наглядно представить такую структуру, обычно используют пространственные кристаллические решетки. Они состоят из определенного количества узлов, которые образуют центры молекул или атомов конкретного вещества. Обычно такая решетка построена из ионов, входящих в состав нужных молекул. Так, в поваренной соли внутренняя структура состоит из ионов натрия и хлора, попарно объединенных в молекулы. Подобные кристаллические тела называются ионными.
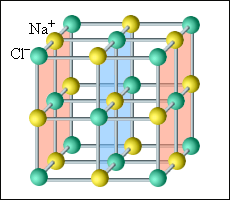
Рисунок Кристаллическая решетка поваренной соли.
В структуре каждого вещества можно выделить одну минимальную составляющую – элементарную ячейку.
Вся решетка, из которой состоит кристаллическое тело, может быть составлена путем трансляции (параллельного переноса) такой ячейки в определенных направлениях.
Основные виды кристаллических решеток
Число видов кристаллических решеток не бесконечно. Всего насчитывается видов, большинство которых создано искусственным путем или найдено в природных материалах. Структурные решетки могут принимать формы объемно центрированных кубов (например, у железа), гранецентрированных кубов (у золота, меди), призмы с шестью гранями (магний, цинк).
В свою очередь кристаллические тела подразделяются на поликристаллы и монокристаллы. Большинство веществ относятся к поликристаллам, т.к. они состоят из так называемых кристаллитов. Это маленькие кристаллики, сросшиеся между собой и ориентированные хаотически. Монокристаллические вещества встречаются сравнительно редко, даже среди искусственных материалов.
Поликристаллы обладают свойством изотропности, то есть одинаковыми свойствами во всех направлениях.
Поликристаллическая структура тела хорошо видна под микроскопом, а у некоторых материалов, например, чугуна, и невооруженным взглядом.
Полиморфизм – это возможность вещества существовать в нескольких фазах, т.е. кристаллических модификациях, которые отличаются друг от друга физическими свойствами.
Процесс перехода в другую модификацию получил название полифморного перехода.
Примером такого явления может быть превращение графита в алмаз, который в промышленных условиях происходит при высоком давлении (до атмосфер) и высоких температурах
(до ).
Чтобы изучить структуру кристаллической решетки монокристалла или поликристаллического образца, используется дифракция рентгеновского излучения.
Простые кристаллические решетки показаны на рисунке ниже. Необходимо учитывать, что расстояние между частицами так мало, что сопоставимо с размерами самих этих частиц. Для наглядности на схемах показаны только положения центров.
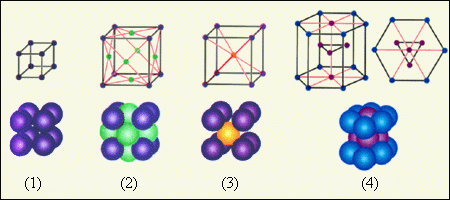
Рисунок Простые кристаллические решетки: – простая кубическая решетка; – гранецентрированная кубическая решетка; – объемноцентрированная кубическая решетка; – гексагональная решетка.
Наиболее простой является кубическая решетка: такая структура состоит из кубов с частицами в вершинах. Гранецентрированная решетка имеет частицы не только в вершинах, но и на гранях. Например, кристаллическая решетка поваренной соли представляет собой две гранецентрированные решетки, вложенные друг в друга. Объемноцентрированная решетка имеет дополнительные частицы в центре каждого куба.
У решеток металлов есть одна важная черта. Ионы вещества удерживаются на своих местах благодаря взаимодействию с газом свободных электронов. Так называемый электронный газ образуется за счет одного или нескольких электронов, отдаваемых атомами. Такие свободные электроны могут перемещаться по всему объему кристалла.

Рисунок Структура металлического кристалла.




