- 24 июля 2025
- 7 минут
- 4 592
Полосатые и линейчатые спектры
Статью подготовили специалисты образовательного сервиса Zaochnik.
Если солнечный свет проходит через стеклянную призму либо дифракционную решетку, тогда появляется хорошо известный всем непрерывный спектр (рисунок ).

Рисунок . Непрерывный спектр
Спектр называют непрерывным, поскольку в нем есть все длины волн видимого диапазона, начиная от красной границы и заканчивая фиолетовой. Для нас непрерывный спектр предстает в виде разноцветной сплошной полосы.
Непрерывный спектр существует не только в солнечном излучении, но и, к примеру, в свете электрической лампы. Как оказалось, любое твердое и жидкое тело (и даже плотный газ), нагретое до высокой температуры, дает излучение непрерывного спектра.
Ситуация меняется при наблюдении свечения разреженных газов. Спектр перестает быть непрерывным, так как в нем возникают разрывы, которые увеличиваются по мере разрежения газа. В предельном случае чрезмерно разреженного атомарного газа спектр превращается в линейчатый, то есть состоящий из отдельных довольно тонких линий.
Рассмотрим вида линейчатых спектров излучения: испускания и поглощения.
Спектр испускания
Допустим, газ состоит из атомов какого-то химического элемента и разрежен настолько, что атомы практически не взаимодействуют друг с другом. Раскладывая в спектр излучение данного газа (нагретого до довольно высокой температуры), мы наблюдаем примерно такую картину, как на рисунке .

Рисунок . Линейчатый спектр испускания
Данный линейчатый спектр, который образован тонкими изолированными цветными линиями, называют спектром испускания.
Всякий атомарный разреженный газ издает свет с линейчатым спектром. Кроме того, для всякого химического элемента спектр испускания уникальный, поскольку играет роль «удостоверения личности» данного элемента. Набор линий спектра испускания однозначно говорит, какой химический элемент перед нами.
Так как газ разрежен и атомы слабо взаимодействуют друг с другом, делаем заключение, что свет излучают атомы сами по себе. Поэтому атом характеризуется дискретным, строго определенным набором длин волн испускаемого света. Каждый химический элемент, как мы уже отметили, имеет свой набор.
Спектр поглощения
Атомы испускают свет, переходя из возбужденного состояния в основное. Однако вещество может не только испускать, но и поглощать свет. Атом, поглощий свет, совершает обратный процесс – преобразуется из основного состояния в возбужденное.
Вновь рассмотрим разреженный атомарный газ, но уже в холодном состоянии (то есть при довольно низкой температуре). Свечения газа происходить не будет, поскольку в не нагретом состоянии газ не излучает свет, атомов в возбужденном состоянии оказывается для этого очень мало.
Если сквозь холодный газ проходит свет с непрерывным спектром, тогда появляется картина, как на рисунке .

Рисунок . Линейчатый спектр поглощения
На фоне непрерывного спектра ниспадающего света возникают темные линии, образующие так называемый спектр поглощения.
Откуда эти линии появляются?
Под воздействием ниспадающего света атомы газа преобразуются в возбужденное состояние. Причем для возбуждения атомов пригодны не любые длины волн, а только некоторые, строго определенные для этой разновидности газа. Как раз эти длины волн газ и «забирает себе» из света.
Необходимо отметить, что газ изымает из непрерывного спектра точно те самые длины волн, которые издает сам! Темные линии в спектре поглощения газа точно соответствуют ярким линиям его спектра излучения. На рисунке сопоставляются спектры испускания и поглощения разреженных паров натрия.
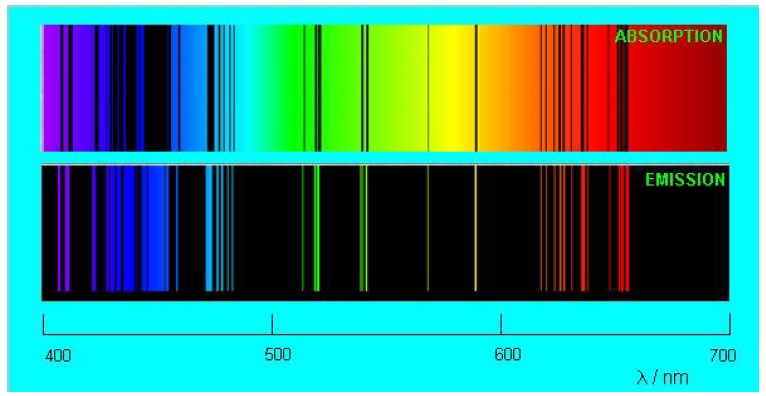
Рисунок . Спектры поглощения и испускания для паров натрия
Совпадение линий впечатляет, не так ли?
Рассматривая спектры поглощения и испускания, ученые-физики XIX в. сделали вывод, что атом – это делимая частица и имеет некоторую внутреннюю структуру. На чем-то же должен работать механизм излучения и поглощения света внутри атома!
Помимо этого, уникальность атомных спектров означает то, что данный механизм различается у атомов различных химических элементов. Значит, атомы различных химических элементов должны отличаться по своей внутренней структуре.
Спектральный анализ
Применение линейчатых спектров как уникальных «паспортов» химических элементов заложено в спектральном анализе – методе исследования химического состава вещества по его спектру.
Идея спектрального анализа несложная: спектр излучения анализируемого вещества сопоставляется с эталонными спектрами химических элементов, после чего делается заключение о наличии или отсутствии того или иного химического элемента в этом веществе. При определенных обстоятельствах методом спектрального анализа определяют качественный и количественный состав химического элемента.
В конце наблюдения разных спектров появились новые химические элементы.
Первыми такими элементами были цезий и рубидий. Они были названы по цвету линий своего спектра (в спектре цезия ярко выражены линии небесно-синего цвета, по-латыни называемого “caesius”; рубидий, в свою очередь, испускает характерные линии рубинового цвета).
В -м г. в спектре солнечного света ученые обнаружены линии, не соответствующие ни одному из открытых на то время химических элементов. Новый элемент назвали гелием (от греческого “гелиос” означает “солнце”). В дальнейшем гелий обнаружили в атмосфере Земли.
Нужно отметить, что спектральный анализ излучения Солнца и звёзд показал: все входящие в их состав элементы имеются и на планете Земля. Таким образом, оказалось, что все объекты нашей Вселенной собраны из одного и того же химического набора.




