- 24 июля 2025
- 5 минут
- 5 764
Электрический ток в электролитах
Статью подготовили специалисты образовательного сервиса Zaochnik.
Электролиты – это проводящие среды, в которых протекает электрический ток, сопровождающийся переносом вещества.
Какие вещества являются электролитами. Электролиз
Положительно и отрицательно заряженные ионы являются носителями свободных зарядов в электролитах. Соединения металлов в расплавленном состоянии, некоторые твердые вещества относят к электролитам. Основными их представителями являются водные растворы неорганических кислот, солей, оснований. Их широко применяют в технике.
При прохождении электрического тока через электролит происходит одновременное выделение веществ на электродах. Данное явление получило название электролиза.
Электрический ток в электролитах рассматривается как перемещение ионов с обоими знаками в противоположных направлениях.
Движение положительных ионов направлено к отрицательному электроду (катоду), а отрицательных – к положительному электроду (аноду). Появление ионов с противоположными знаками в водных растворах солей, кислот, щелочей является следствием расщепления нейтральных молекул. Явление получило название электролитической диссоциации.
При диссоциации в водном растворе хлорида меди на ионы меди и хлора получаем выражение:
.
Рисунок показывает принцип упорядоченного движения положительных ионов меди к катоду, а отрицательных ионов хлора – к аноду вследствие подключения электродов к источнику тока при действии электрического поля на эти ионы.
После достижения катода ионы меди нейтрализуются избыточным количеством его электронов и переходят в состояние нейтральных атомов, оседающих на катоде. Ионы хлора, добравшись к аноду, отдают по одному электрону. После чего происходит соединение попарно нейтральных атомов хлора для образования молекулы хлора . Его наличие обусловлено выделением пузырьков на аноде.
Многие реакции электролиза сопровождаются вторичными реакциями продуктов разложения, которые выделяются на электродах, с его материалом или растворителями.
Примером может служить электролиз раствора сульфата меди (медного купороса) при опущенных в электролит электродов, изготовленных их меди.
Диссоциация молекул сульфата меди идет согласно формуле:
.
Нейтральные атомы меди оседают в виде твердого осадка на катоде. Таким образом получается химически чистая медь. При отдаче ионом двух электронов аноду становится нейтральным радикалом , который вступает во вторичную реакцию с медным анодом:
.
Получившаяся молекула сульфата меди переходит в раствор. Это показывает прохождение электрического тока через водный раствор сульфата меди для растворения медного анода и оседания меди на катоде. Концентрация данного раствора не меняется.
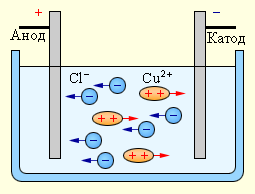
Рисунок Электролиз водного раствора хлорида меди.
Закон электролиза
В году М. Фарадеем был установлен закон электролиза.
Закон Фарадея определяет количества первичных продуктов, которые выделяются во время электролиза на электродах. Масса вещества, выделившегося на электроде, прямо пропорциональна заряду , прошедшему через электролит:
, где является электрохимическим эквивалентом.
Масса вещества, выделившегося на электроде, равняется массе всех ионов, пришедших к электроду, и запишется .
Значения и являются массой и зарядом одного иона соответственно, а - числом ионов, пришедших к электроду при прохождении через электролит с зарядом . Отсюда следует, что электрохимический эквивалент равняется отношению массы иона данного вещества к его заряду .
Заряд иона является произведением валентности вещества на элементарный заряд , тогда запись выражения для примет вид
.
Значение является постоянной Авогадро, - молярной массой вещества, - постоянной Фарадея.
.
Постоянная Фарадея численно равняется заряду, который следует пропустить через электролит, для выделения на электроде одного моля одновалентного вещества.
Запись закона Фарадея для электролиза имеет вид
.
Явление электролиза широко применимо в современном промышленном производстве.




