- 24 июля 2025
- 12 минут
- 7 634
Теплоёмкость идеального газа
Статью подготовили специалисты образовательного сервиса Zaochnik.
В случае, если результатом теплообмена становится передача телу некоего количества теплоты , то его температура и внутренняя энергия претерпевают изменения.
Необходимое для нагревания вещества на количество теплоты носит название удельной теплоемкости вещества , а ее формула выглядит следующим образом:
.
В большом количестве ситуаций удобной для использования является молярная теплоемкость :
, где представляет собой молярную массу вещества.
Теплоемкость, полученная таким способом, не является однозначной характеристикой вещества. Исходя из первого закона термодинамики, можно сказать, что изменение внутренней энергии тела зависимо не только от количества полученной теплоты, но и от величины совершенной телом работы. В разных условиях осуществления процесса теплопередачи тело может совершать различную работу. Таким образом, переданное телу одинаковое количество теплоты способно провоцировать изменения его внутренней энергии и, соответственно, температуры.
Подобной неоднозначностью при определении теплоемкости характеризуются только газообразные вещества. Объем в процессе нагрева практически не меняет своей величины, что сводит работу расширения к нулю. По этой причине вся полученная телом теплота уходит на изменение его внутренней энергии. Газ в процессе теплопередачи может значительно менять свой объем и совершать работу, чем отличается от твердых тел и жидкостей. Таким образом, теплоемкость газообразного вещества имеет зависимость от характера термодинамического процесса.
Изопроцессы в газах
Чаще всего рассматриваются два значения теплоемкости газов:
- являющаяся молярной теплоемкостью в изохорном процессе ;
- представляющая собой молярную теплоемкость в изобарном процессе .
При условии постоянного объема газ не совершает работы: . Исходя из первого закона термодинамики для газа, можно сказать, что справедливым является следующее выражение:
.
Изменение величины внутренней энергии газа прямо пропорционально изменению значения его температуры.
В условиях процесса при постоянном давлении первый закон термодинамики дает такую формулу:
.
В котором является изменением объема идеального газа при изменении его температуры на . Таким образом, можно заявить, что:
.
Из уравнения состояния идеального газа, записанного для , может выражаться отношение :
.
В котором представляет собой универсальную газовую постоянную. При условии постоянства давления , можно записать следующее: или .
Из этого следует, что выражающее связь между молярными теплоемкостями и соотношение имеет вид (формула Майера):
В процессе с неизменным давлением молярная теплоемкость газа всегда превышает молярную теплоемкость в процессе с не подверженным изменениям объемом, что демонстрируется на рисунке .
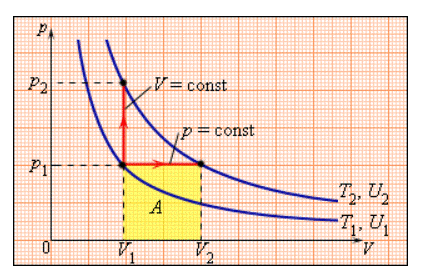
Рисунок Два возможных процесса нагревания газа на . При газ совершает работу . Поэтому .
Отношение теплоемкостей в процессах с постоянным давлением и постоянным объемом занимает важное место в термодинамике и обозначается в виде греческой буквы .
.
Данное отношение включено в формулу для адиабатического процесса.
Между двумя изотермами, обладающими температурами и на диаграмме реальны различные варианты перехода. Так как для всех подобных переходов изменение величины температуры является одним и тем же, выходит, что изменение значения
внутренней энергии тоже одинаково. С другой стороны, совершенные при этом работы и количества теплоты , полученные в результате теплообмена, выйдут разными для различных путей перехода. Из этого следует, что газа имеет относительно приближенное к бесконечности число теплоемкостей. и представляют собой частные, однако, очень важные для теории газов, значения теплоемкостей.
Рисунок Модель теплоемкости идеального газа.
Термодинамические процессы, в которых теплоемкость газа не подвергается изменениям, носят название политропических.
Каждый изопроцесс являются политропическим. В изотермическом процессе , из-за чего . В адиабатическом процессе , выходит, что .
Стоит обратить внимание на то, что «теплоемкость» и «количество теплоты» являются крайне неудачными терминами, доставшимися современной науке в качестве наследства теории теплорода, которая господствовала в XVIII веке.
Данная теория представляла теплоту в виде содержащегося в телах особого невесомого вещества. Считалось, что оно не подвержено уничтожению и не может быть созданным. Явление нагрева объясняли повышением, а охлаждение – понижением содержания в телах теплорода. Однако теория теплорода оказалась несостоятельной, так как не смогла дать ответа на вопрос, почему одинаковое изменение внутренней энергии тела возможно получить, приводя ему разное количество теплоты в зависимости от совершаемой им работы. По этой причине утверждение, что в данном теле содержится некоторый запас теплорода лишено смысла.
Молекулярно-кинетическая теория
В молекулярно-кинетической теории устанавливается следующее соотношение между средней кинетической энергией поступательного движения молекул и абсолютной температурой :
.
Внутренняя энергия идеального газа эквивалентна произведению на число Авогадро:
.
При условии изменения температуры на величину внутренняя энергия изменяется на величину:
.
Коэффициент пропорциональности между и эквивалентен теплоемкости в условиях постоянного давления:
Данное выражение подтверждается экспериментами с газами, которые состоят из одноатомных молекул вроде гелия, неона или аргона. При этом для двухатомных (водород, азот) и многоатомных (углекислый газ) газов такое соотношение не согласуется с полученными в результате опытов данными. Причина этого расхождения заключается в том, что для двух- и многоатомных молекул средняя кинетическая энергия должна включать энергию как поступательного, так и вращательного их движения.
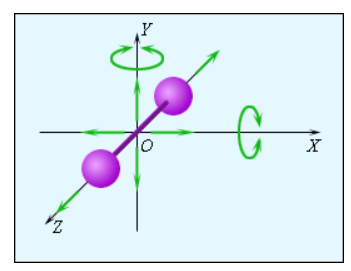
Рисунок Модель двухатомной молекулы. Точка совпадает с центром масс молекулы.
Рисунок иллюстрирует модель двухатомной молекулы. Молекула имеет возможность производить пять независимых типов движений: три поступательных движения вдоль осей и два вращения относительно осей и .
Опытным путем выяснено, что вращение относительно оси , на которой лежат центры обоих атомов, может быть возбуждено только при очень высоких значениях температуры. В условиях обычных температур вращение вокруг оси не происходит.
Каждое независимое движение в молекуле носит название степени свободы.
Выходит, что одноатомная молекула обладает поступательными степенями свободы, «жесткая» двухатомная молекула степенями, то есть поступательными и вращательными, а многоатомная молекула степенями свободы, из которых приходятся на поступательные и на вращательные.
В классической статистической физике доказывается теорема о равномерном распределении энергии по степеням свободы:
Если система молекул находится в тепловом равновесии при температуре , то средняя кинетическая энергия равномерно распределена между всеми степенями свободы и для каждой степени свободы молекулы она равна .
Из данной теоремы следует, что для молярных теплоемкостей газа и и их отношения
справедлива запись в следующем виде:
,
где представляет собой количество степеней свободы газа.
Для газа, состоящего из одноатомных молекул
.
Для газа, состоящего из двухатомных молекул
.
Для газа, состоящего из многоатомных молекул
.
В обычных условиях экспериментально измеренные теплоемкости многих газов неплохо согласуются с приведенными выражениями, но в целом классическая теория теплоемкости газов вполне удовлетворительной не является. Существует колоссальное число примеров со значительной разницей между результатами эксперимента и теорией. Данный факт объясняется тем, что классическая теория не может полностью учесть, связанную с внутренними движениями в молекуле энергию.
Теорема о равномерном распределении энергии по степеням свободы может быть применена и по отношению к тепловому движению частиц в твердом теле. Входящие в состав кристаллической решетки атомы колеблются около положений равновесия. Энергия данных колебаний представляет собой внутреннюю энергию твердого тела. Каждый конкретный атом может колебаться в кристаллической решетке в трех взаимно перпендикулярных направлениях. Выходит, что каждый атом имеет колебательные степени свободы. При условии гармонических колебаний средняя кинетическая энергия эквивалентна средней потенциальной энергии. По этой причине в соответствии с теоремой о равномерном распределении на каждую колебательную степень свободы приходится средняя энергия , а на один атом – .
Внутренняя энергия твердого вещества равна следующему выражению:
.
Следовательно, молярная теплоемкость вещества в твердом состоянии равняется:
.
Данное выражение носит название закона Дюлонга–Пти. Для твердых тел почти нет различия между и по причине пренебрежительно малой работы при сжатии или расширении.
Опыт показывает, что молярная теплоемкость у многих твердых тел (химических элементов) при обычных температурах на самом деле близка к . При этом, в условиях низких температур заметны довольно сильные расхождения между теорией и экспериментом. Таким образом, гипотеза о равномерном распределении энергии по степеням свободы может считаться лишь приближением. Заметная в опыте зависимость теплоемкости от температуры объясняется только при условии использования квантовых представлений.




