- 24 июля 2025
- 7 минут
- 9 163
Внутренняя энергия. Количество теплоты. Работа в термодинамике
Статью подготовили специалисты образовательного сервиса Zaochnik.
Термодинамика - раздел физики, изучающий превращения энергии в макроскопических системах и основные свойства этих систем.
Термодинамика опирается на общие закономерности тепловых процессов и свойств макроскопических систем. Выводы термодинамики эмпирические, то есть опираются на факты, проверенные опытным путем с использованием молекулярно-кинетической модели.
Для описания термодинамических процессов в системах, состоящих из большого числа частиц, используются величины, не применимые к отдельным молекулам и атомам: температура, давление, концентрация, объем, энтропия)
Термодинамическое равновесие - состояние макросопической системы, когда описывающие ее макроскопические величины остаются неизменными.
В термодинамике рассматриваются изолированные системы тел, находящиеся в термодинамическом равновесии. То есть в системах с прекращением всех наблюдаемых макроскопических процессов. Особую важность представляет свойство, которое получило название выравнивания температуры всех ее частей.
При внешнем воздействии на термодинамическую систему наблюдается переход в другое равновесное состояние. Он получил название термодинамического процесса. Когда время его протекания достаточно медленное, система приближена к состоянию равновесия. Процессы, состоящие из последовательности равновесных состояний, называют квазистатическими.
Внутренняя энергия. Формулы
Внутренняя энергия считается важнейшим понятием термодинамики. Макроскопические тела (системы) имеют внутреннюю энергию, состящую из энергии каждой молекулы. Исходя из молекулярно-кинетической теории, внутренняя энергия состоит из кинетической энергии атомов и молекул, а также потенциальной энергии их взаимодействия.
Например, внутренняя энергия идеального газа равняется сумме кинетических энергий частиц газа, которые находятся в непрерывном беспорядочном тепловом движении. После подтверждений большим количеством экспериментов, был получен закон Джоуля:
Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема.
Применение молекулярно-кинетической теории говорит о том, что выражение для определения внутренней энергии одноатомного газа, с поступательными движениями молекул записывается как:
.
Зависимость от расстояния между молекулами у потенциальной энергии очевидна, поэтому внутренняя и температура обусловлены изменениями :
.
Определение внутренней энергии производится с помощью наличия макроскопических параметров, характеризующих состояние тела. Изменение внутренней энергии происходит по причине действия на тело внешних сил, совершающих работу. Внутренняя энергия является функцией состояния системы.
Когда газ в цилиндре сжимается под поршнем, то внешние силы совершают положительную работу . Силы давления газа на поршень также совершают работу, но равную . При изменении объема газа на величину , говорят, что он совершает работу , где – давление газа, – площадь поршня, – его перемещение. Подробно показано в примере на рисунке 1.
Наличие знака перед работой говорит о работе газа в разных состояниях: положительная при расширении и отрицательная при сжатии. Переход из начального в конечное состояние работы газа может быть описан с помощью формулы:
или в пределе при :
.
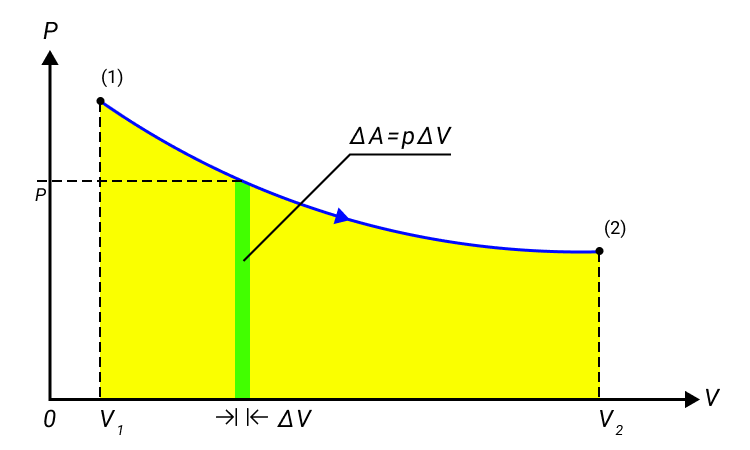
Рисунок 1. Работа газа при расширении.
Обратимые и необратимые процессы
Работа численно равняется площади процесса, изображенного на диаграмме . Величина зависит от метода перехода от начального состояния в конечное. Рисунок 2 показывает процесса, которые переводят газ из состояние в состояние . Во всех случаях газ совершает работу.
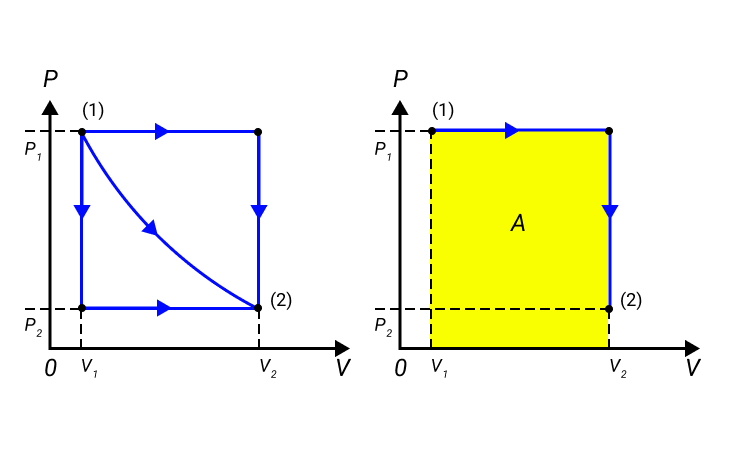
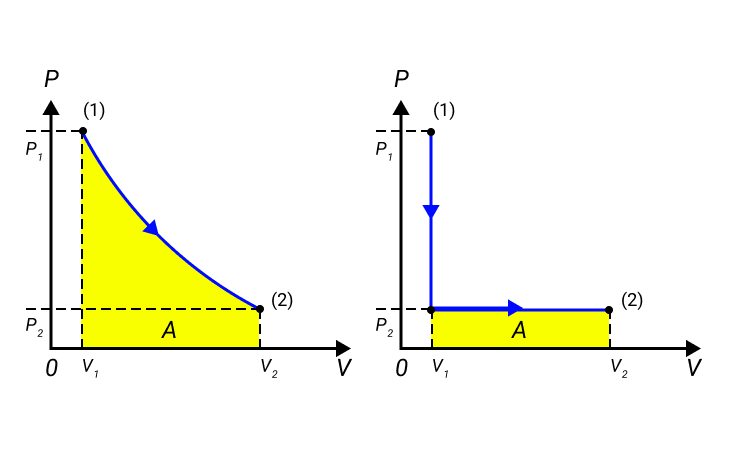
Рисунок 2. Три различных пути перехода из состояния в состояние . Во всех трех случаях газ совершает разную работу, равную площади под графиком процесса.
Процессы из рисунка 2 возможно провести в обратном направлении. Тогда произойдет изменение знака на противоположный.
Процессы, которые возможно проводить в обоих направлениях, получили название обратимых.
Жидкости и твердые тела могут незначительно изменять свой объем, поэтому при совершении работы разрешено им пренебречь. Но их внутренняя энергия подвергается изменениям посредствам совершения работы.
Механическая обработка деталей нагревает их. Это способствует изменению внутренней энергии. Имеется еще один пример опыта Джоуля года, служащий для определения механического эквивалента теплоты, изображенного на рисунке 3. Во время вращения катушки, находящейся в воде, внешние силы совершают положительную работу , тогда жидкость повышает температуру из-за наличия силы трения, то есть происходит увеличение внутренней энергии.
Процессы примеров не могут проводиться в противоположных направлениях, поэтому они получили название необратимых.

Рисунок 3. Упрощенная схема опыта Джоуля по определению механического эквивалента теплоты.
Изменение внутренней энергии возможно при наличии совершаемой работы и при теплообмене. Тепловой контакт тел позволяет увеличиваться энергии одного тела с уменьшением энергии другого. Иначе это называется тепловым потоком.
Количество теплоты
Количество теплоты , полученное телом, называется его внутренней энергией, получаемой в результате теплообмена.
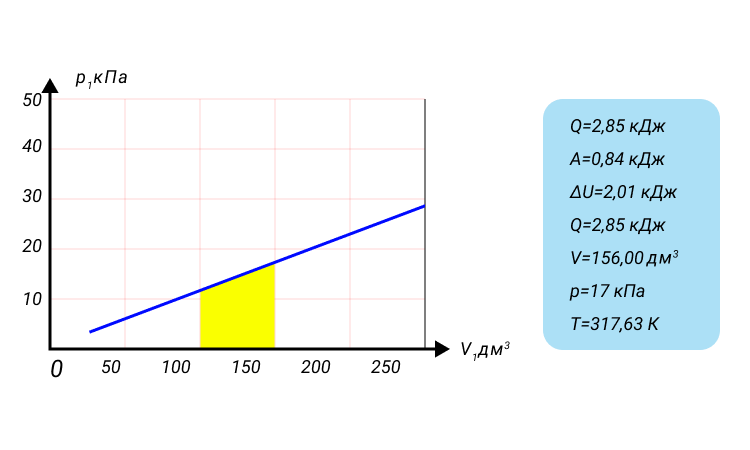
Рисунок 4. Модель работы газа.
Процесс передачи тепла тел возможен только при разности их температур.
Направление теплового потока всегда идет к холодному телу.
Количество теплоты считается энергетической величиной и измеряется в джоулях .




